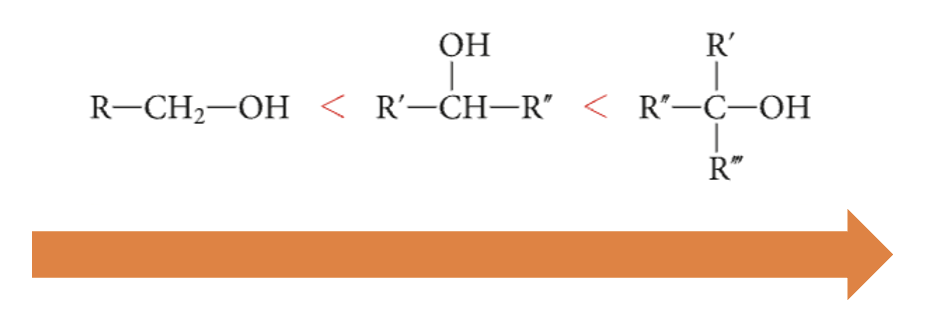Gli alcoli si comportano da acidi di Brønsted e Lowry
Per la presenza del legame O – H fortemente polarizzato, gli alcoli in acqua cedono uno ione idrogeno (H+) all’acqua (base) con formazione di uno ione alcossido (RO–) e dello ione ossonio (H3O+)

La forza di un acido si esprime quantitativamente mediante la costante di dissociazione acida Ka, espressa dalla seguente relazione:
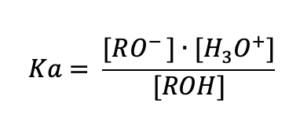
Gli alcoli sono acidi molto deboli perchè hanno valori molto bassi della costante di di dissociazione acida Ka. Poichè questi valori sono molto piccoli si preferisce esprimere l’acidità con i valori di pKa. Ka e pKa sono legati dalla seguente relazione:
![]()
Un alcol è tanto più acido quanto maggiore è il valore di Ka, quindi minore sarà il valore di pKa.
Riepilogando:
Maggiore forza acida dell’alcol – Maggiore Ka – Minore pKa
Minore forza acida dell’alcol – Minore Ka – Maggiore pKa
Dai valori di Ka e pKa risulta che gli alcoli primari sono più acidi di quelli secondari e questi sono più acidi di quelli terziari.
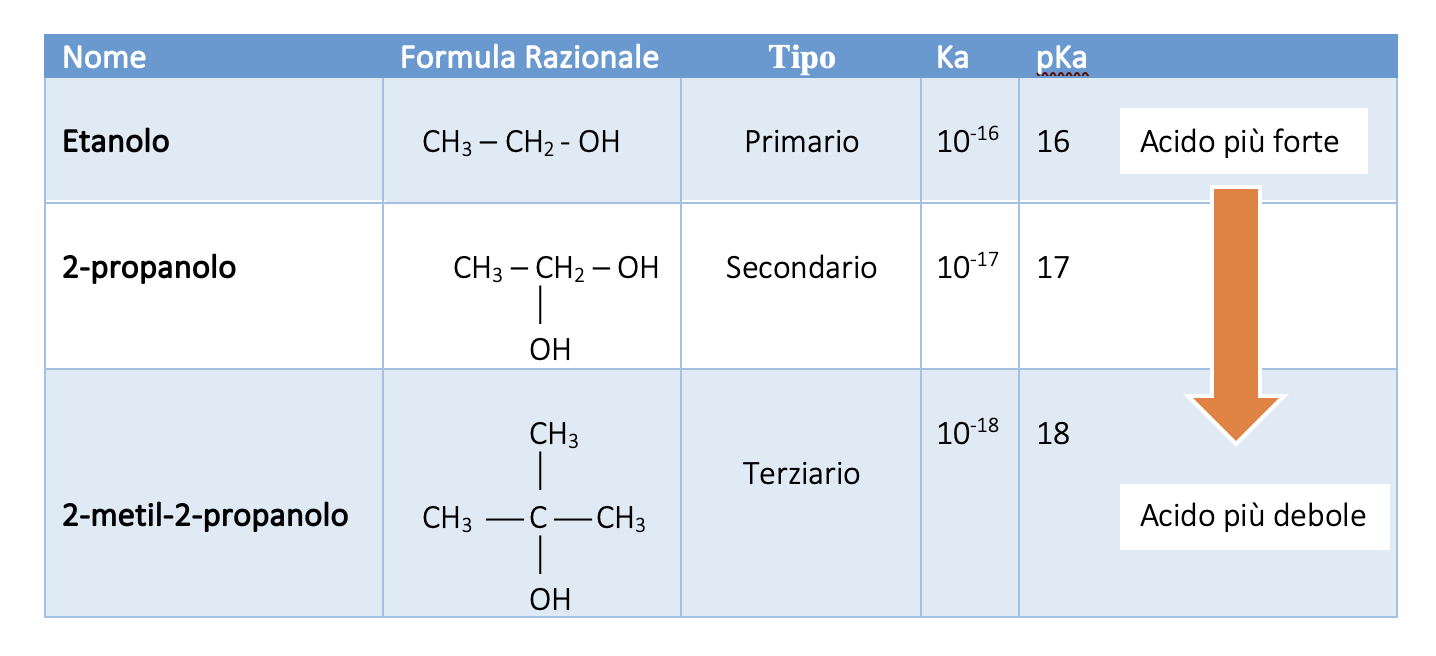
L’ordine di acidità crescente è il seguente:
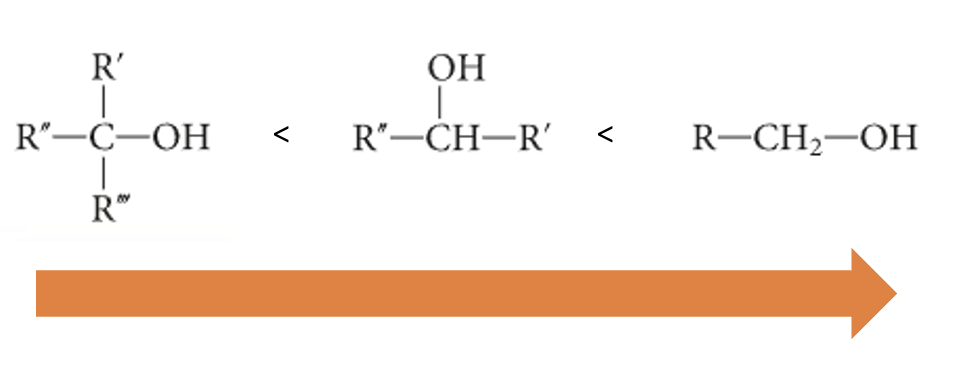
La presenza di un gruppo alchilico o di un alogeno nella molecola dell’alcol può aumentare o diminuire l’acidità per effetto induttivo. I sostituenti elettron-donatori (gruppi alchilici) diminuiscono l’acidità, mentre i sostituenti elettron-attrattori (alogeni) aumentano l’acidità
Ad esempio il 2,2-dimetil-1-propanolo è meno acido dell’1-propanolo. La diversa acidità si giustifica con la presenza nella molecola del 2,2-dimetil-1-propanolo di più gruppi alchilici elettron-donatori, che diminuiscono la tendenza dell’ossigeno ad attrarre gli elettroni di legame condivisi con l’idrogeno.
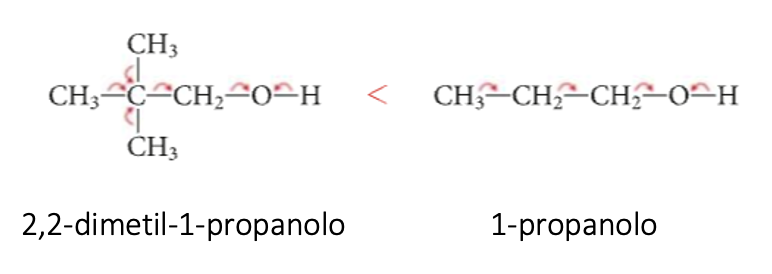
Anche l’etanolo è meno acido dell’1-cloroetanolo: la diversa acidità si giustifica con la presenza nell’1-cloroetanolo dell’atomo di cloro che, essendo elettronattrattore, aumenta la tendenza dell’atomo di ossigeno ad attrarre gli elettroni di legame con l’idrogeno.
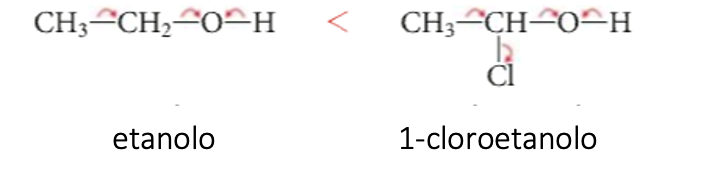
Gli acidi si comportano da basi di Lewis
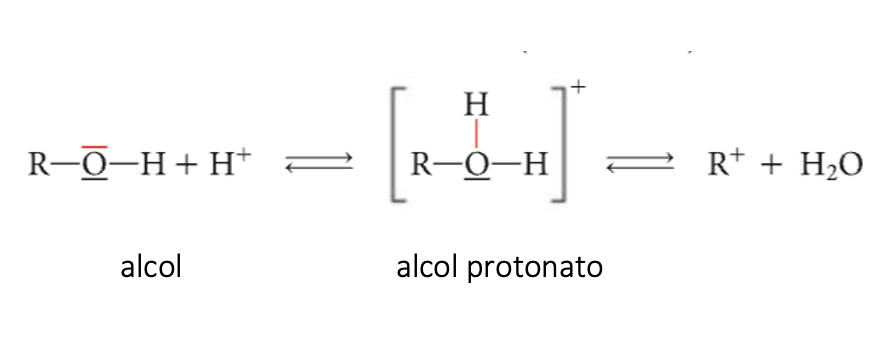
Per la presenza di due doppietti elettronici liberi sull’atomo di ossigeno, gli alcoli si possono comportare da basi di Lewis, in quanto possono condividere un doppietto elettronico con uno ione idrogeno H+
L’alcol legandosi allo ione idrogeno H+ di un acido, forma un alcol protonato. Questo alcol è un composto intermedio instabile che successivamente libera acqua con formazione di un carbocatione (R+)
Gli alcoli sono basi molto deboli. Gli alcol terziari sono più basici di quelli secondari e di quelli primari. Questa proprietà si giustifica con la maggiore stabilità del carbocatione terziario rispetto al carbocatione secondario e primario. Essendo che gli alcoli si possono comportare sia da acidi che da basi, sono considerati composti anfoteri. L’ordine di basicità crescente è il seguente: