A temperatura ambiente, i primi dodici termini sono allo stato liquido, i termini superiori sono allo stato solido.
Gli alcoli sono composti polari; l’ossigeno, ha un’elettronegatività di 3.5 superiore all’idrogeno e carbonio. L’elevata elettronegatività induce sul carbonio e idrogeno una parziale carica positiva frazionaria mentre l’ossigeno diventa parzialmente negativo.

Due molecole di alcoli interagiscono a causa dell’attrazione dipolo-dipolo, in a cui si aggiunge il legame a idrogeno.
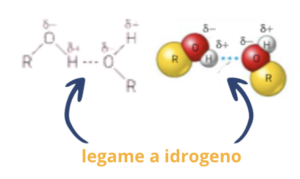
I legami a idrogeno sono legami deboli, ma il loro grande numero fa si che occorre somministrare molta energia, sotto forma di calore, per rompere tutti i legami. Questo spiega le alte temperature di ebollizione degli alcoli rispetto agli idrocarburi, agli alogenuri alchilici e agli eteri aventi la stessa massa molecolare.
La presenza del gruppo idrofilo -OH conferisce agli alcoli la possibilità di formare legami a idrogeno intermolecolari con le molecole di acqua. Questi legami sono responsabili dell’alta solubilità degli alcoli a bassa massa molecolare.
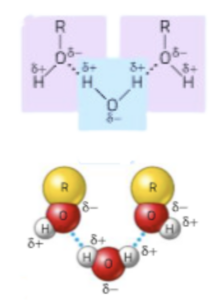
Aumentando la massa molecolare il gruppo alchilico idrofobico (R) prevale sul gruppo idrofilo (-OH) e la solubilità diminuisce.
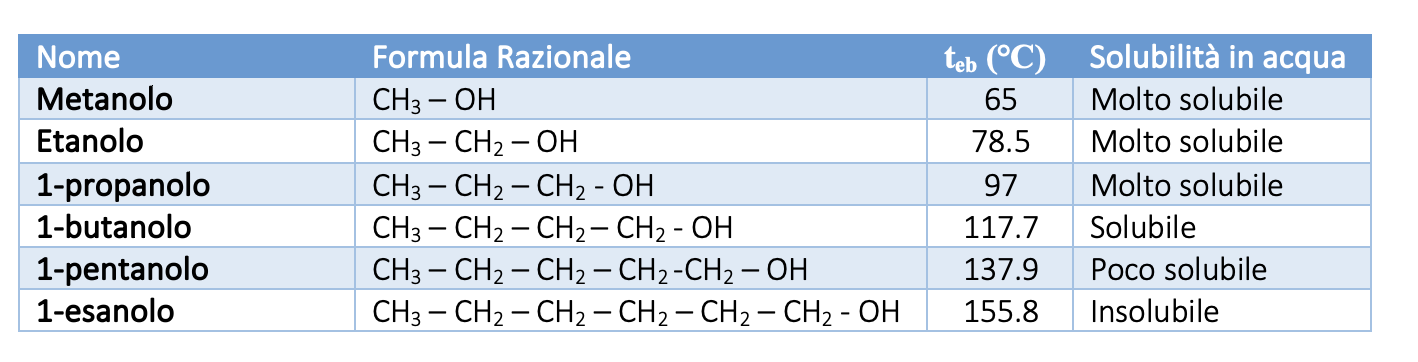
La seguente tabella mostra la solubilità in acqua dei primi sei termini degli alcoli saturi a catena lineare, si può osservare che aumentando la massa molecolare, aumenta la temperatura di ebollizione e diminuisce la solubilità: l’esanolo è praticamente insolubile in acqua, questo alcol e i successivi saranno solubili nei solventi organici, come per esempio benzina, etere, benzene, cloroformio.